
Service Hotline
400-685-1800

大脑中含多种多巴胺能神经元(dopamine neuron, DA)亚型,位于中脑腹侧的多巴胺能神经元(midbrain dopaminergic neuron, mDA)分为A8、A9和A10亚型,占整个DA的75%,其中又以A9和A10亚型mDA为主。尽管mDA同起源于中脑腹侧底板区,但其解剖学结构和生理功能均存在巨大差异。A9亚型mDA主要投射至背侧纹状体调控机体的随意运动,其异常是导致帕金森病的主要原因;而A10亚型mDA则投射至纹状体腹侧区的伏隔核、杏仁核,以及前额叶皮层等较广的范围,调控奖赏、动机、情绪、决策等重要行为,其异常与精神分裂症、抑郁症、焦虑等精神疾病密切相关。
将人多能干细胞诱导分化为A9或A10亚型mDA不仅为上述不同类型脑疾病的致病机制研究提供精准的人源细胞模型,同时也为此类疾病的细胞替代治疗提供大量可再生细胞资源。中脑多巴胺能神经元位于中后脑交接处,在脑发育过程中,该细胞的特化受到来自前脑WNT1,中脑峡部FGF8,以及腹侧底板和脊索分泌的SHH等多种信号通路的梯度调控。尽管对于中脑mDA的发育和信号调控通路已相对清晰,但对于不同亚型mDA(A9, A10)在发育过程中如何产生及其分子调控机制目前尚不清楚,因此,体外诱导分化获得不同mDA亚型,尤其是A10亚型仍然是领域内的空白。
复旦大学脑科学研究院熊曼研究员与中科院脑智卓越中心陈跃军研究员合作在Cell Stem Cell杂志以封面论文发表了题为“Human stem cell-derived A10 dopaminergic neurons specifically integrate into mouse circuits and improve depression-like behaviors”的研究论文,该研究发现A10亚型mDA的命运特化除了需要经典的WNT/FGF8/SHH信号调控外,还需要NOTCH信号通路,GDNF和抗坏血酸(Ascorbic Acid,AA)的共同调控。该研究还发现大量A10亚型mDA的命运特化可发生在其前体细胞退出细胞周期后。移植的A10亚型mDA可整合入小鼠内源奖赏相关神经环路,有效缓解模型小鼠的抑郁/焦虑样行为。
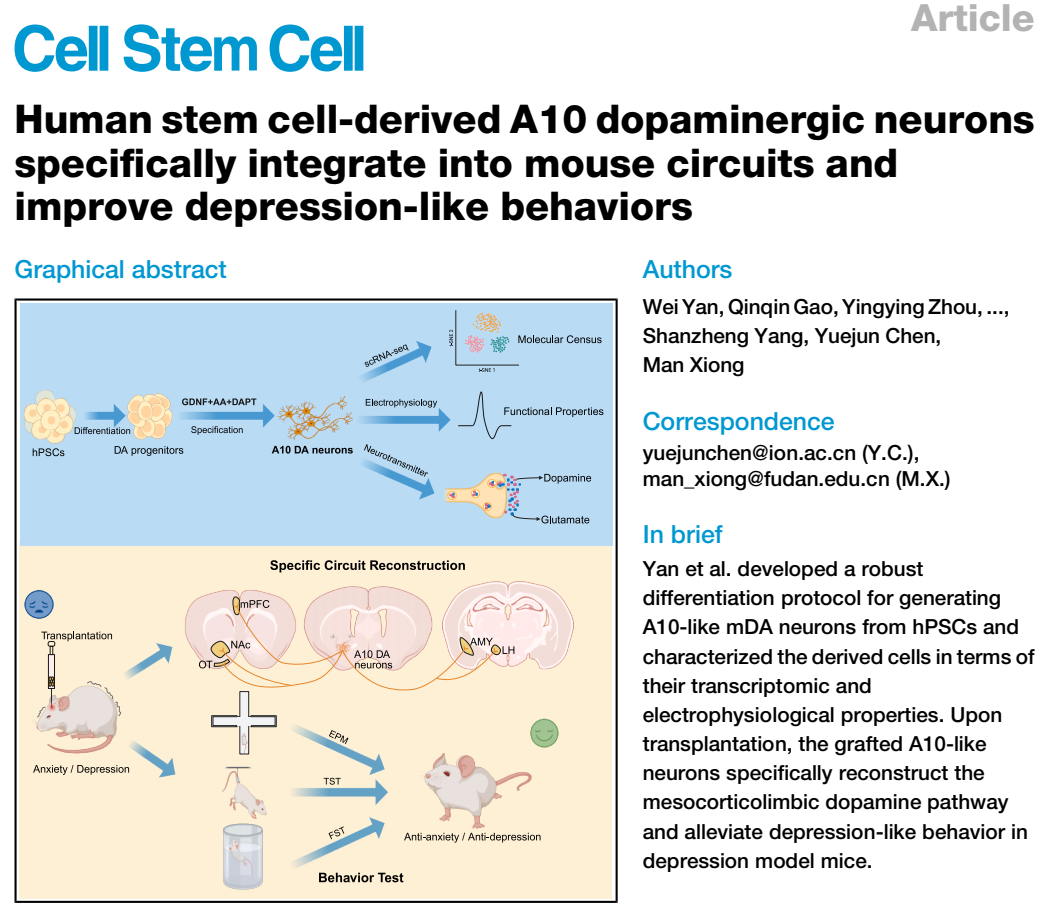
为了研究A10亚型的分化,研究团队首先利用CRISPR-Cas9建立了高效的多重基因编辑技术,构建了可以特异性追踪A9亚型(TH+-EGFP-)和A10亚型mDA(TH+-EGFP+)细胞系(TH-tdTomato/CALB1-EGFP),及光或化学激活A10 mDA等的多个细胞系(TH-vCre/CALB1-vloxp-stop-vloxp-iCre/AAVS1-DIO-CHR2-EYFP, TH-iCre/CALB1-LSL-vCre/AAVS1-vloxp-stop-vloxp-loxp-EGFP-loxp-hM3Dq–mCherry)(图1)。
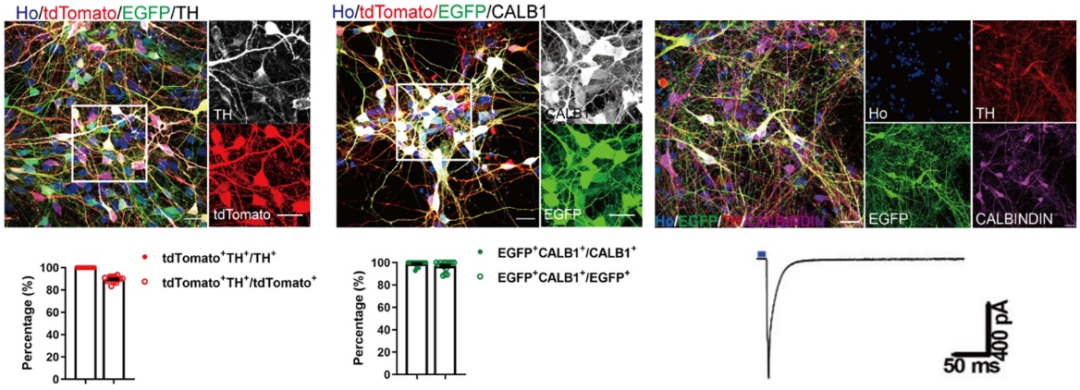
图1 从人类胚胎干细胞中生成类似A10的多巴胺能神经元。
接着,研究人员探索了A10多巴胺能神经元大量产生的关键时间段和诱导小分子组合,通过逐步减少候选小分子的方法,最终锁定GAD(GDNF, AA, DAPT)三种小分子组合可显著促进A10亚型mDA的大量产生。为了进一步探究A10 mDA何时开始大量产生,研究人员构建了代表有丝分裂后多巴胺细胞的报告细胞系并通过流式分选这些细胞,结果证明使用GAD处理促进大量A10亚型mDA的命运特化可发生在有丝分裂后阶段(图2)。
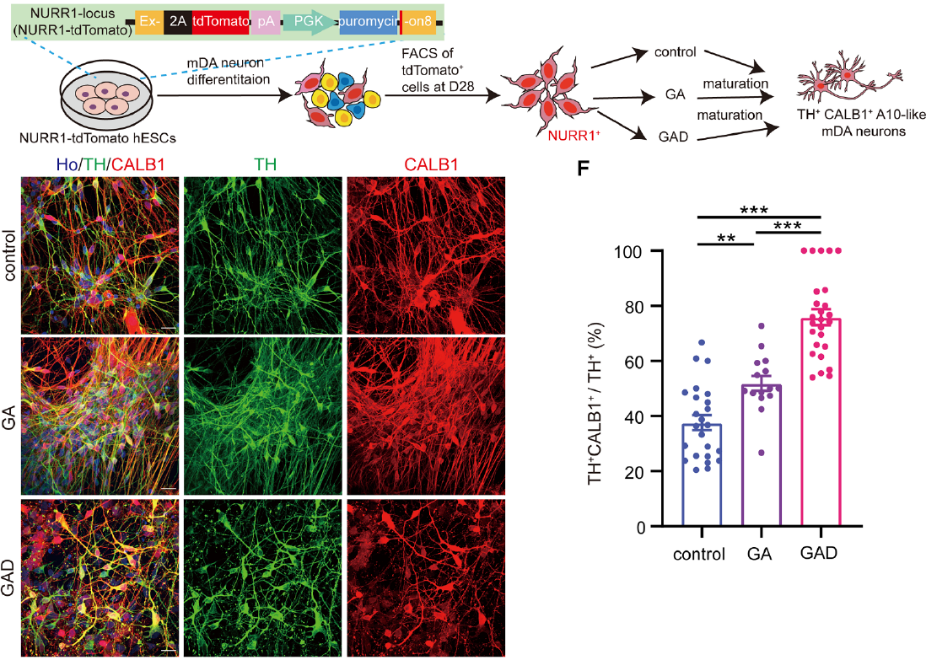
图2 由Notch信号通路调控的A10样多巴胺能神经元亚型的特异性描述。
研究组分别把人多能干细胞定向分化为A9 mDA亚型和A10 mDA亚型,并结合流式分选和单细胞转录组测序数据,发现A9亚型mDA主要富集了与帕金森病相关通路,而A10亚型mDA主要富集了与药物成瘾等通路。同时,A10亚型mDA共表达谷氨酸转运体SLC17A6,这与文献报道的A10 mDA亚型有谷氨酸共释放的特征一致。这些结果在单细胞转录组层面进一步证明研究团队高效获得了A10亚型mDA(图3)。
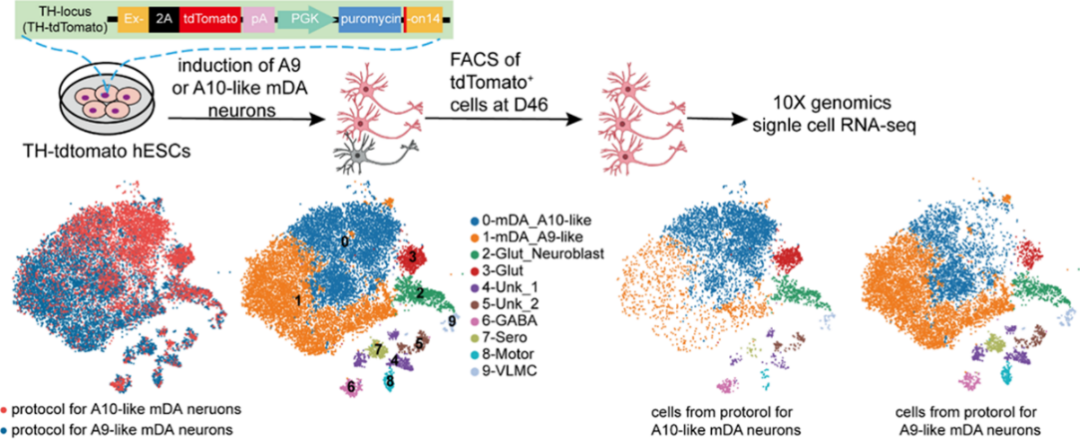
图3 基于TH-tdTomato报告基因hES细胞系所获得的mDA细胞群的分子分类。
由于A9和A10亚型mDA参与大脑不同神经环路,且具有不同的电生理特征,研究团队进一步将TH-tdTomato/CALB1-EGFP分化获得的A10亚型神经元原位移植到小鼠中脑VTA脑区或异位移植到小鼠的腹侧纹状体脑区,有趣的发现无论是原位移植还是异位移植,A10亚型多巴胺能神经元轴突均主要投射至mPFC,NAc等内源神经支配区域(图4)。
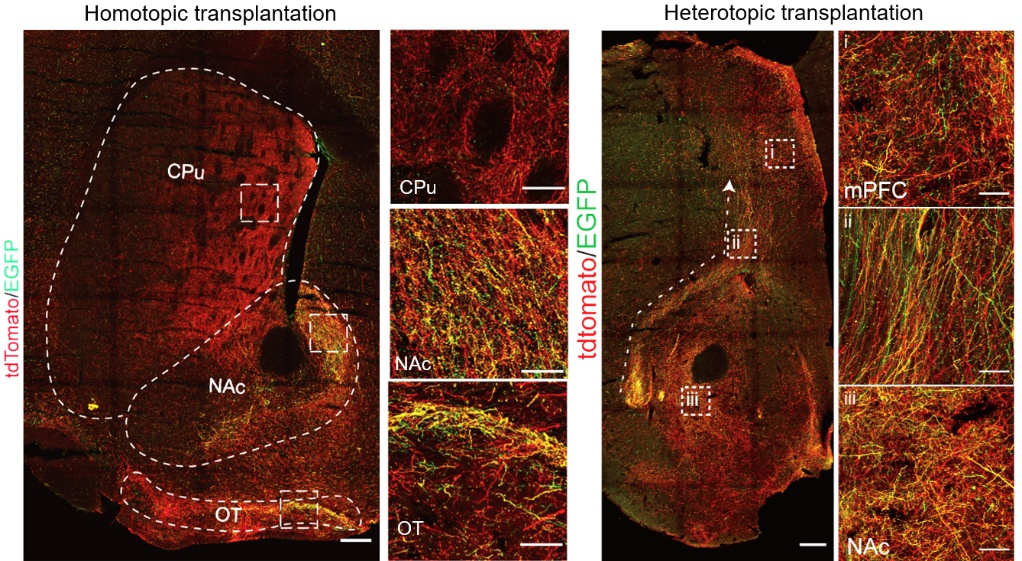
图4 同源移植的多巴胺神经元的亚型特异性轴突投射。
最后,为了验证分化获得的A10亚型mDA是否对神经精神类疾病具有潜在的治疗作用,研究团队将细胞移植到与小鼠焦虑和抑郁高度相关腹侧纹状体脑区。通过慢性束缚应激建立抑郁模型,结果显示通过化学遗传方法激活移植的A10亚型mDA的细胞活性可显著缓解小鼠焦虑/抑郁样行为(图5)。
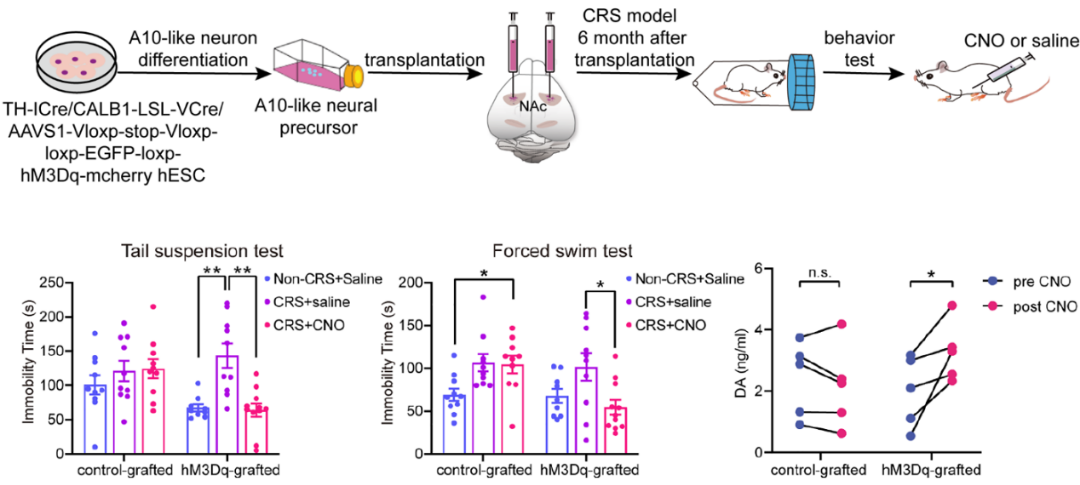
图5 移植小鼠的抗焦虑和抗抑郁样行为。
结论与讨论
本研究发现在多巴胺能神经元分化后期添加GAD小分子处理,可获得大量A10亚型多巴胺能神经元,并证明移植该细胞可有效缓小鼠解焦虑/抑郁样行为。尽管本研究通过构建基因报告细胞系将A9和A10亚型有效的区分,但仍然不清楚在发育过程中哪些关键的信号通路决定了不同亚型mDA细胞命运的产生。未来可能需要结合精准的谱系示踪和多组学测序明确不同亚型mDA命运特化的动态过程和信号调控。
另外,本研究中发现A10亚型mDA无论移植到原位(移植到A10 mDA内源VTA脑区)还是异位移植(移植到内源A10 mDA投射的靶标区域)均能特异投射到内源靶标区域mPFC,NAC等脑区,提示细胞内在属性在神经细胞亚型特异性的神经环路重建中扮演非常重要的角色,同时也暗示成年大脑可能仍存在一套支持移植细胞进行精准环路重构的微环境。未来,能否找到宿主与移植细胞互作通路以促进移植细胞更快、更精准的进行神经环路的结构和功能重建,对于脑疾病的干细胞移植治疗迈向临床至关重要。
实验延展
目前研究中,文章是通过微透析结合HPLC检测了移植后NAc区域的多巴胺浓度变化,证实了移植神经元的功能性释放。然而,该方法存在时间分辨率低(分钟级)且无法实时反映神经递质动态波动的情况。北京铭泰佳信科技有限公司自主研发的活体脑化学物质实时分析系统,能够实时捕捉脑内多种化学物质的动态变化,例如多巴胺、葡萄糖、乳酸、抗坏血酸、pH、钾离子、钙离子等,高时间分辨率,可达到毫秒级实时检测记录。
 具体技术延伸:
具体技术延伸:
1、通过在移植区域(如NAc)植入特异性多巴胺电极,观察:移植神经元是否在行为任务(如SPT、FST)中实时释放多巴胺,释放幅度、频率与行为改善是否同步。
2、评估移植神经元与宿主环路的整合效率,通过检测局部场电位(LFP)与化学信号耦合:判断移植神经元是否与宿主神经元形成功能性突触连接,分析神经振荡(如theta振荡)与多巴胺释放的关系。
3、优化移植策略与时机,在不同移植时间点、位置(NAc vs. VTA)实时监测多巴胺水平:评估最佳移植窗口与位置,指导个体化治疗策略。
4、联合光遗传/化学遗传调控与实时化学记录,在激活hM3Dq或ChR2的同时,实时记录多巴胺变化:直接验证“激活→释放→行为改善”因果链。为临床转化提供精准调控依据。