
Service Hotline
400-685-1800

动物从非母性向母性状态的转变伴随着神经与行为的深刻重塑,其中在威胁环境下仍优先保护后代的母性防御行为,是母性本能的最高表现之一。以往研究虽已阐明母性照料与激素调节的关联,但对于面对危险时母体如何克服自我保存本能、转而实施防御性保护行为的神经机制,仍缺乏系统解析。母性防御可能涉及一个在威胁信号触发下迅速启动的决策回路,该回路需整合环境威胁、后代存在及母性状态等多重信息,从而实现行为输出的适应性切换,但其具体的神经元类型、环路连接及计算逻辑尚未被揭示。
南方医科大学梁妃学课题组在Nature Communications上发表研究论文,题为“Experience-dependent maternal defense behavior mediated by prefrontal cortical projections to the medial preoptic area in mice”。该研究通过建立“威胁情境下幼崽救援行为模型”,综合运用在体钙成像、环路操控与行为分析等手段,首次揭示内侧前额叶皮层第六层中特定表达D1多巴胺受体的神经元集群,经由向内侧视前区的拓扑投射,构成威胁条件下母性防御行为启动的关键神经通路。该通路不仅在行为选择中发挥核心调控作用,其活性还随母性经验积累而增强,为理解“母性优先”行为形成的神经可塑性基础提供了重要依据。

母性经验依赖的威胁应对行为分化——母鼠在幼崽存在时展现保护性防御策略
研究开发了一套名为“威胁下幼崽寻回(PRUT)”的行为学测试系统,用于系统评估母鼠在遭遇危险时对幼崽的保护反应。实验在特定矩形行为场地中进行:母鼠被置于场地中并自由筑巢于N区,随后实验人员在远离巢穴的T区放置真实幼崽或玩具替代物。当母鼠越过场地中线时,程序将自动触发持续5秒、强度70分贝的威胁性听觉刺激。实验结果显示,当真实幼崽存在时,绝大多数母鼠(93.9%)会迅速冲向幼崽并将其带回安全巢穴,仅有极少数选择独自逃离;相反,当无幼崽在场时,绝大多数母鼠(93.6%)会直接逃回巢穴(图1a-b)。进一步分析发现,尽管两种情境下母鼠的逃跑峰值速度相近,但在幼崽存在时,母鼠的头部方向明显朝向幼崽,且返回巢穴前的移动距离显著增加(图1c-i)。与此形成鲜明对比的是,缺乏母性经验的处女鼠即使面对幼崽存在,仍有96.8%选择独自逃离,其行为模式与无幼崽时基本一致。这一系列对比结果表明,母性防御行为是一种具有母性状态特异性的行为决策模式,其执行依赖于母体经历的获得。
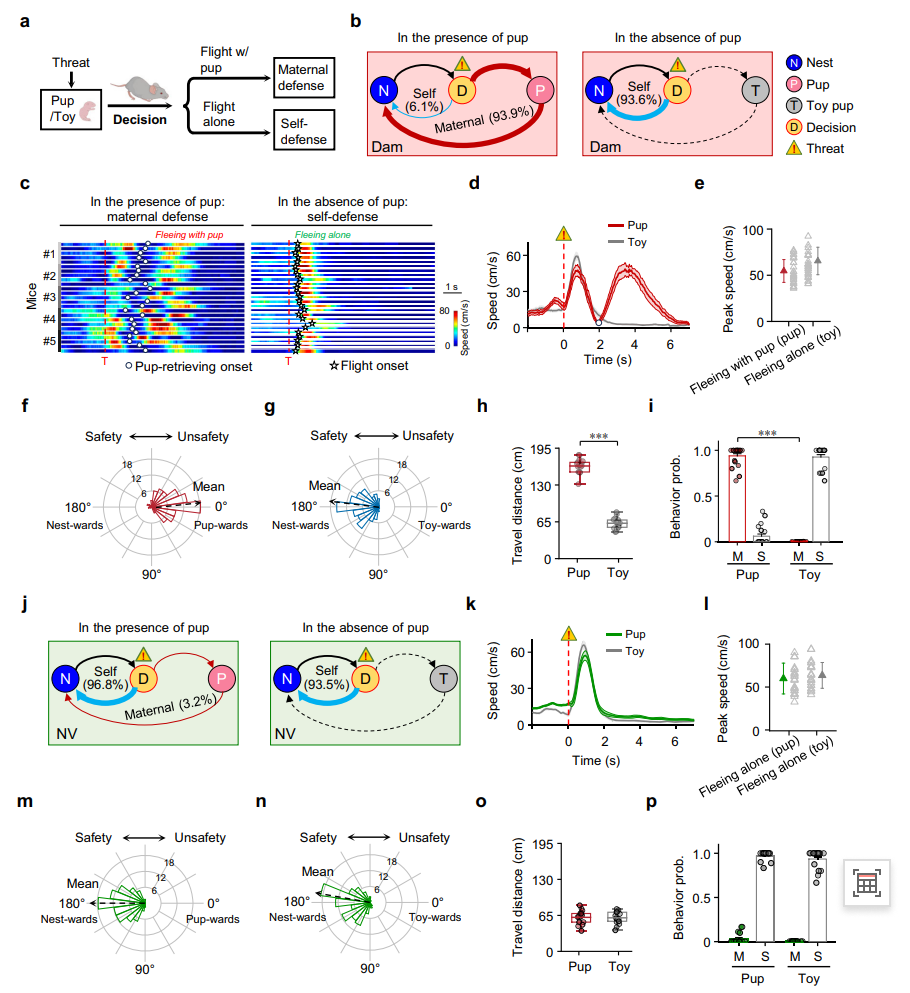
图1 母鼠与无母性经验的处女鼠在威胁条件下的母性防御行为
mPFC神经元动态编码母性防御与自我保护选择
图2旨在通过神经活动标记与功能成像技术,揭示内侧前额叶皮层(mPFC)在母性防御行为中的关键作用及其神经元编码特征。研究首先运用c-Fos染色比较了母鼠在实施母性防御与单纯自我防御后mPFC神经元的激活差异,发现母性防御能更强地激活mPFC,尤其在前边缘皮层(PrL)和下边缘皮层(IL)区域(图2a-b)。为进一步解析神经元在行为过程中的动态编码,研究者通过微型内窥镜钙成像技术,在Thy1-GCaMP转基因母鼠的mPFC深部神经元中记录其钙信号活动(图2c-d)。根据信号与行为事件的关联性,mPFC神经元可被分为两类:“趋近相关细胞”在母鼠冲向幼崽期间活动增强并在威胁呈现后持续上升,而“回收相关细胞”仅在叼起幼崽并返回期间显著激活(图2e-g)。这两类功能特异的神经元群体在母性防御情境下被选择性招募,但在无幼崽的自我防御情境或无母性经验的处女鼠中均未出现类似激活模式(图2h-r)。这些结果共同表明,mPFC中存在特异化的神经元群体,其活动模式与母性防御行为的决策和执行过程密切相关。
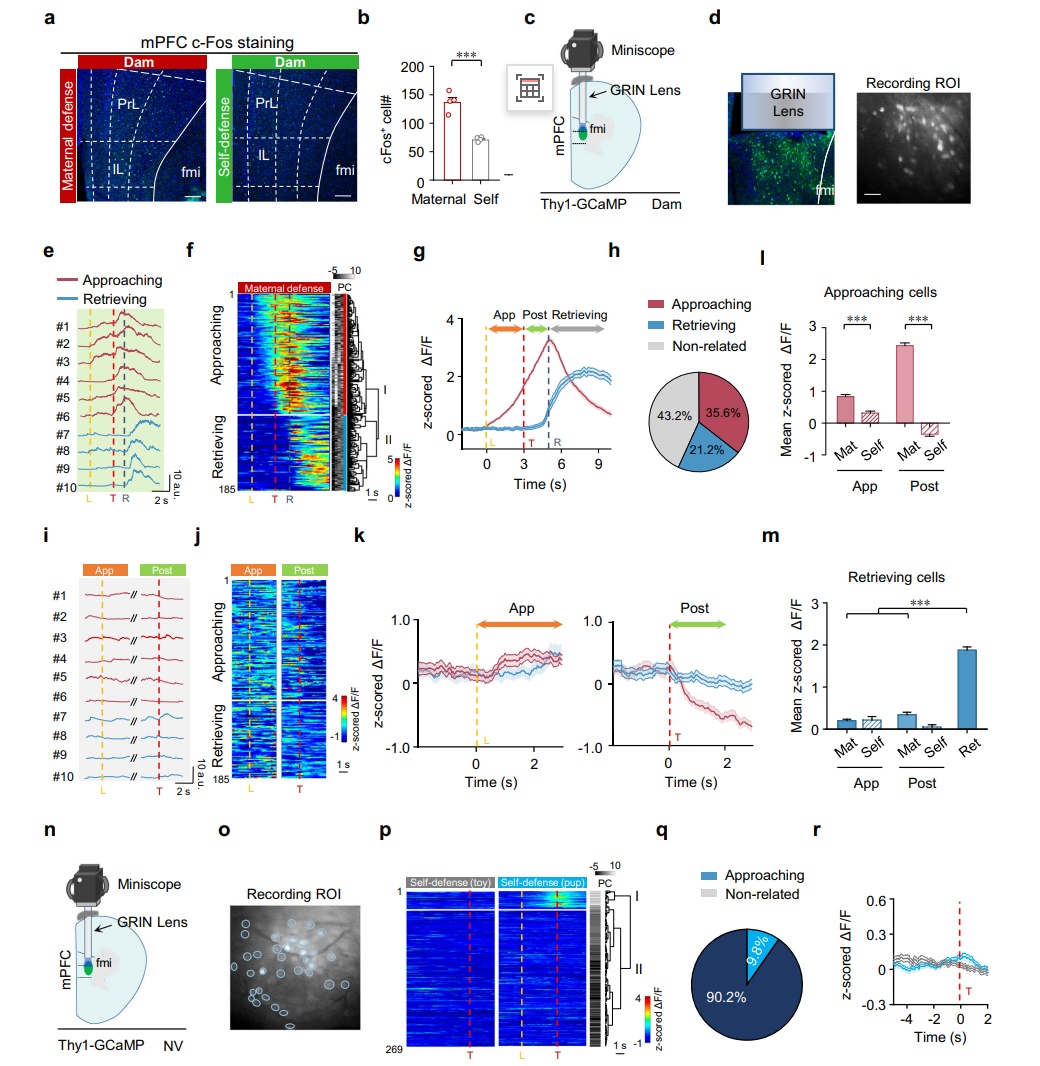
图2 母鼠和无母性经验处女鼠mPFC的神经元群
mPFC神经元活动动态决定行为选择
研究者进一步通过共居母鼠及其幼崽的方式,使处女鼠(EV)获得了母性养育经验。结果显示,EV在面临威胁时取回幼崽的概率显著高于无经验的处女鼠(NV);而在无幼崽的威胁情境下,EV、NV及母鼠(Dam)均主要表现出独自逃跑的行为模式(图3a-c)。通过建立“母性-自我选择指数(MSSI)”进行量化评估,发现母鼠的MSSI值集中于1附近(显著偏向母性防御),NV则集中于-1附近(高度倾向自我保护),而EV的数值呈现介于两者之间的广泛分布,这表明共居经验能有效推动其行为向母性防御转变,但尚未达到成熟母鼠的稳定水平(图3d)。该结果印证了母性防御决策的形成是一个依赖经验积累的可塑性过程。
利用微型显微镜对mPFC神经元进行在体钙成像记录发现,在母性防御试次中,“趋近细胞”的活动水平显著高于其在自我保护试次中的活动,特别是在威胁信号出现之后。基于该群体神经元的活动模式,采用支持向量机(SVM)构建的时间序列解码器,能够有效地区分并预测“母性防御”与“自我保护”两种行为选择,其预测准确率显著优于基于随机数据的对照模型,并通过均方根误差(RMSE)计算进一步验证了模型的可靠性(图3k-m)。更为关键的是,威胁呈现后,该细胞群体的活动动态在两类试次中呈现相反趋势:在母性防御中进一步上升,而在自我保护中则转为下降,这一差异可通过其群体平均活动波形的斜率变化清晰地反映。进一步分析表明,仅凭威胁出现前后活动变化的斜率,即可在单试次水平上高精度地预测动物的行为选择(图3n-p)。这些结果共同提示,mPFC中“趋近细胞”的活动状态是调控母性与自我保护行为抉择的关键神经基础。
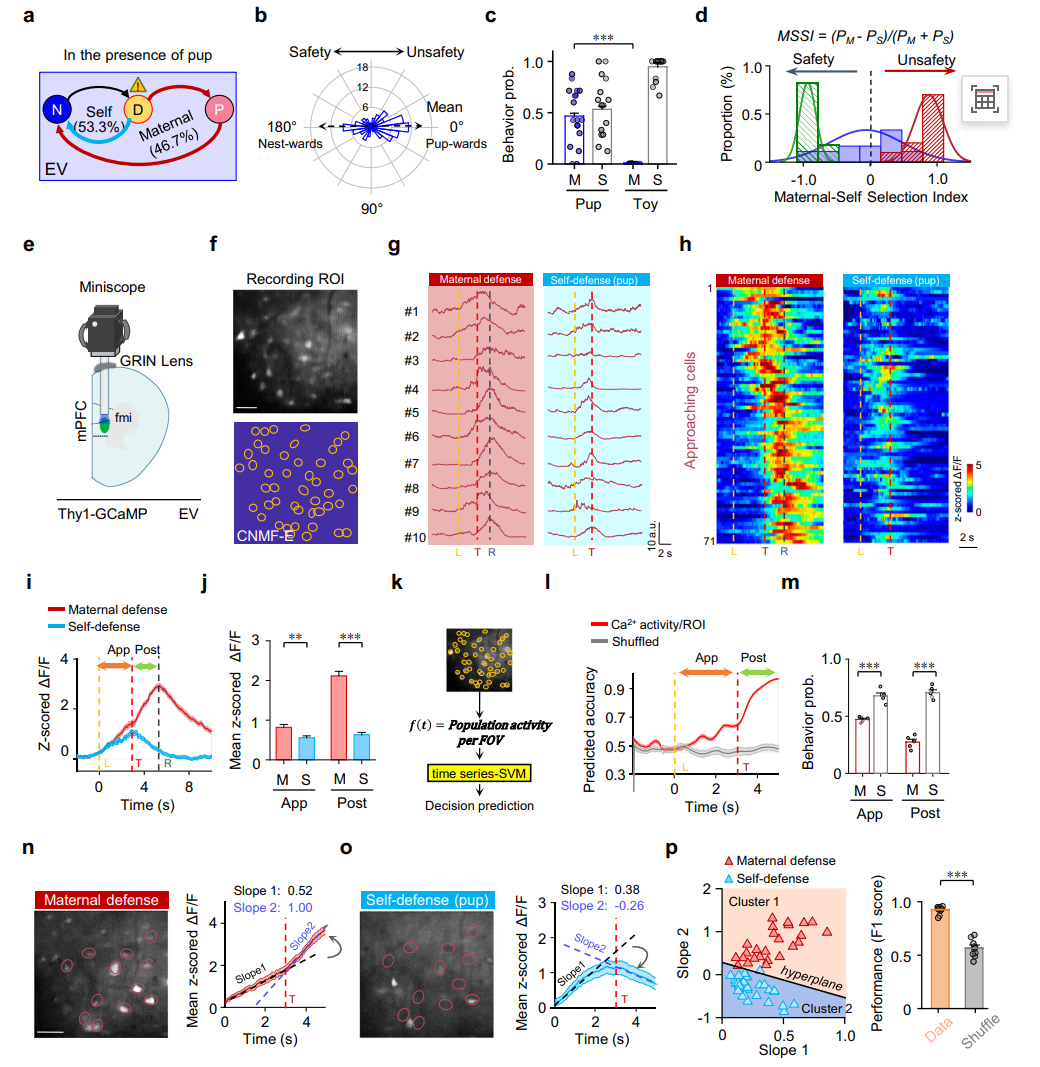
图3 有母性经验处女在行为决策过程中mPFC神经元的活动动力学
mPFC→MPOA投射活性与母性防御行为选择动态相关
为阐明mPFC在母性防御决策中的下游作用通路,本研究聚焦于下丘脑内侧视前区(MPOA)——一个已被广泛证实调控各类母性行为的关键脑区。我们旨在验证以下核心假说:mPFC是否通过其向MPOA的神经投射,在威胁情境下驱动母性防御行为的选择。
为此,文章设计了递进式的环路验证实验(对应图4与图5):
通路确认与相关性验证(图4):首先,通过病毒示踪与脑片电生理记录,在结构层面证实了mPFC谷氨酸能神经元存在向MPOA的直接单突触投射。接着,利用在体光纤光度记录技术,在功能层面监测了该投射通路在行为过程中的活动动态。结果发现,mPFC→MPOA轴突末端的钙信号在母鼠执行“母性防御”时持续升高,而在“自我保护”时则下降;在无经验的处女鼠中,该通路的激活水平整体低下。这初步表明,mPFC→MPOA通路的活动与母性防御行为的选择存在高度相关性。
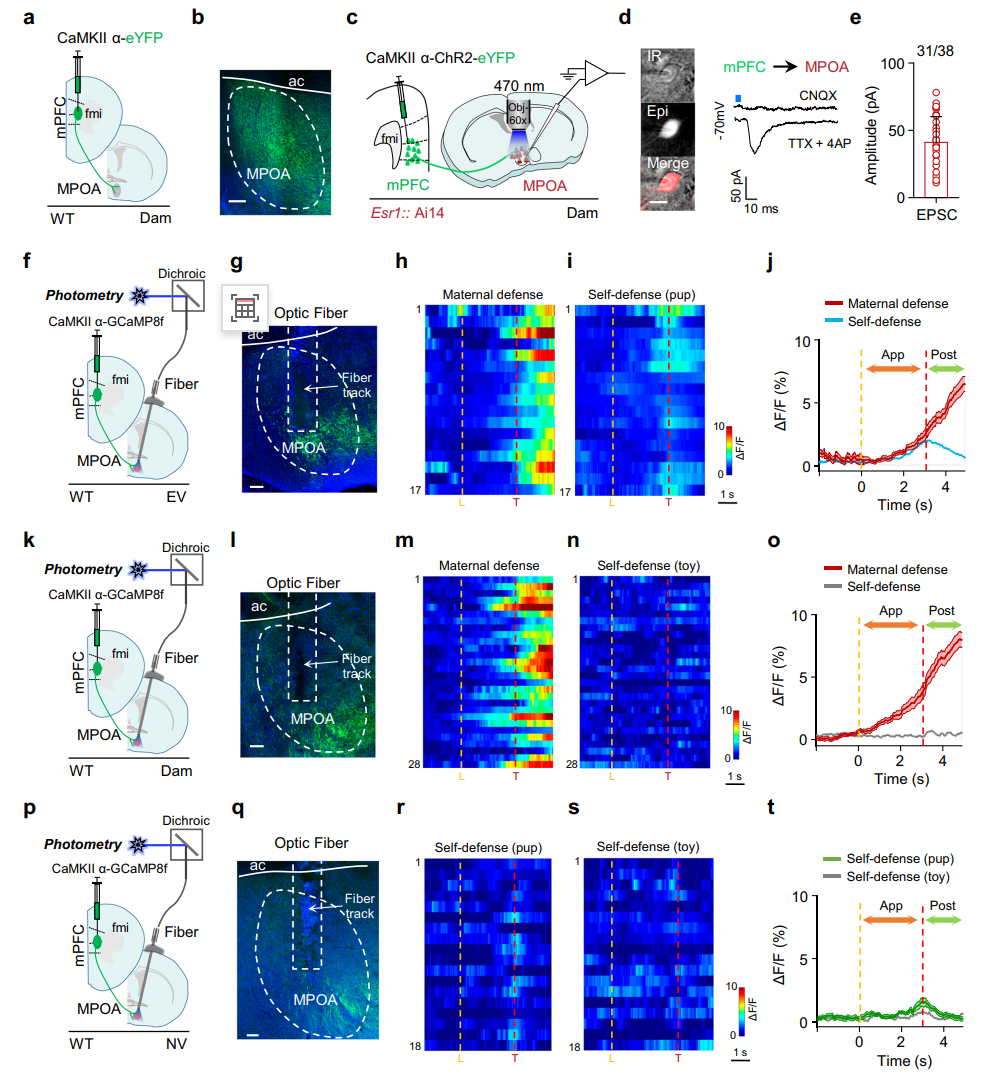
图4 mPFC-MPOA投射与行为选择相关
因果性操控验证(图5):为确立该通路的因果性作用,我们运用了化学遗传学方法对mPFC→MPOA投射进行精确的失活与激活操控。结果显示,在母鼠中抑制该通路,会显著降低其选择母性防御的概率;反之,在处女鼠或经验母鼠中激活该通路,则能有效促进其母性防御行为。这些双向调控实验提供了确凿证据,证明mPFC→MPOA通路的活动不仅是伴随现象,更是驱动“母性优先于自我”这一行为决策的关键动力。
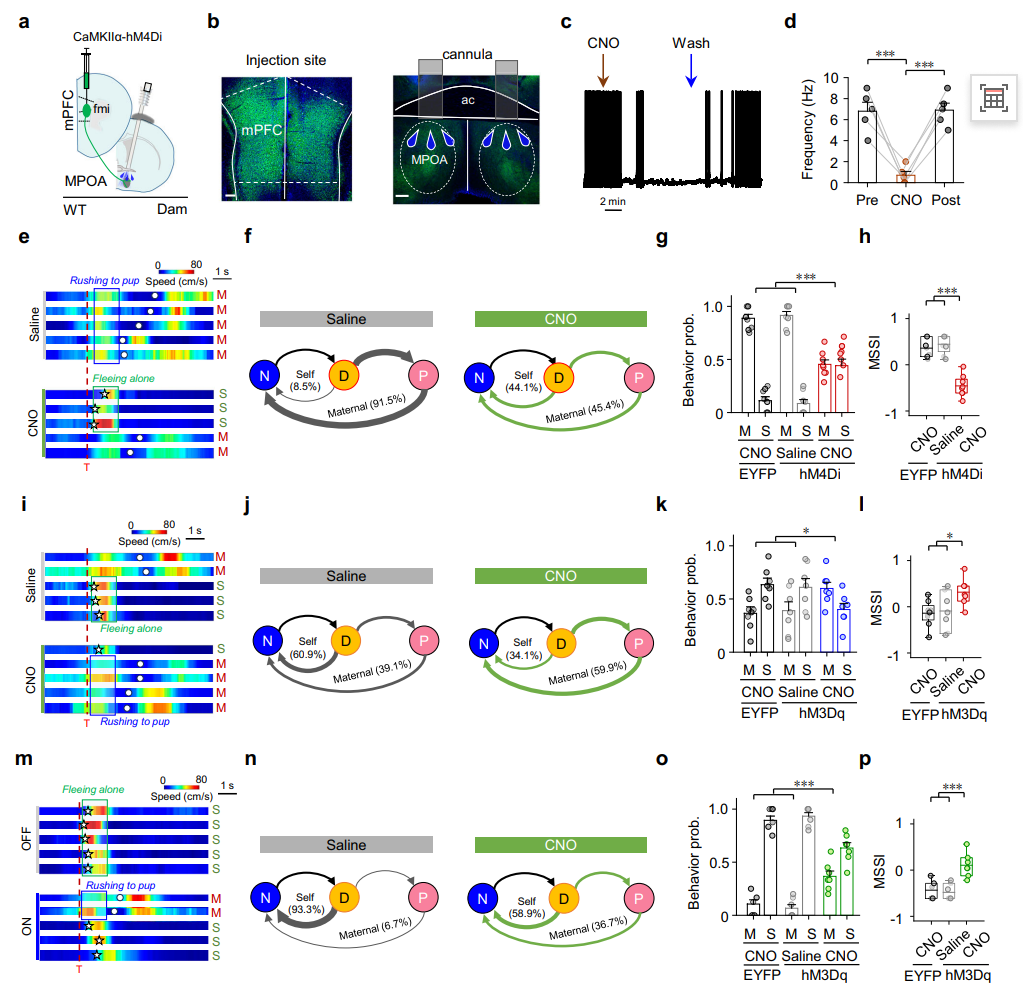
图5 mPFC到MPOA的投射激发了行为选择
mPFC层级特异性投射至MPOA的神经元在母性防御行为中发挥分工协作
通过CTB逆行示踪发现投射至MPOA的mPFC神经元主要分布在第五层(L5)和第六层(L6)(图6a-b);再向MPOA共注射AAV11-EYFP和AAVretro-mCherry病毒,发现AAVretro和AAV11病毒可分别特异性标记皮层L5和L6的投射神经元(图6c-f)。随后结合钙病毒与迷你显微镜记录母鼠L5、L6投射神经元钙反应(图6g-h)均观察到类似趋近相关细胞和取回相关细胞的反应(图6i),但比例不同(L6趋近细胞占主导,比例4.58;L5取回细胞占主导,比例3.90)。对ΔF/F信号的群体平均分析显示投射至MPOA的L6和L5神经元群体的活性动态,分别与定义的趋近相关细胞和取回相关细胞一致,L6群体在幼崽取回前持续升高,L5群体仅在取回后强烈反应(图6k)。
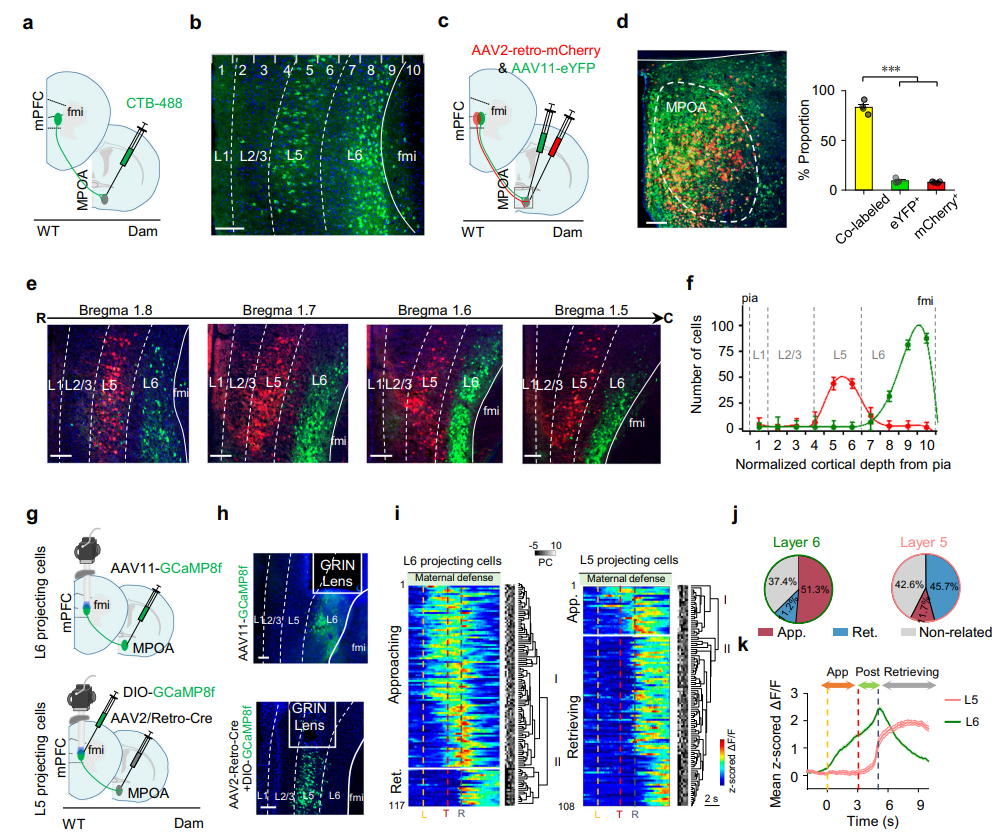
图6 mPFC投射至MPOA的神经元具有层特异性功能
通过光遗传学时序操控实验,系统阐明了mPFC中不同层级神经元向MPOA的投射在母性防御行为中的功能分工。
实验结果显示:在威胁出现后的行为决策阶段(图7e-i),特异性抑制投射至MPOA的L6神经元活性会显著降低母鼠选择救援幼崽的概率,而抑制L5神经元则无此影响;在幼崽衔回的执行阶段(图7j-n),抑制L5神经元会导致幼崽中途掉落、返巢失败,而抑制L6神经元则不影响该过程。这表明L6神经元主导“是否救援”的决策功能,而L5神经元负责“如何衔回”的运动执行。
进一步实验发现(图7o-s),在经验不足的处女鼠面临威胁时,激活其L6神经元在MPOA的轴突末梢能显著提升救援行为的选择概率。这些结果共同证明,mPFC→MPOA通路中L6和L5神经元通过时序性协同作用,分别调控母性防御行为的决策启动与运动执行两个关键环节。
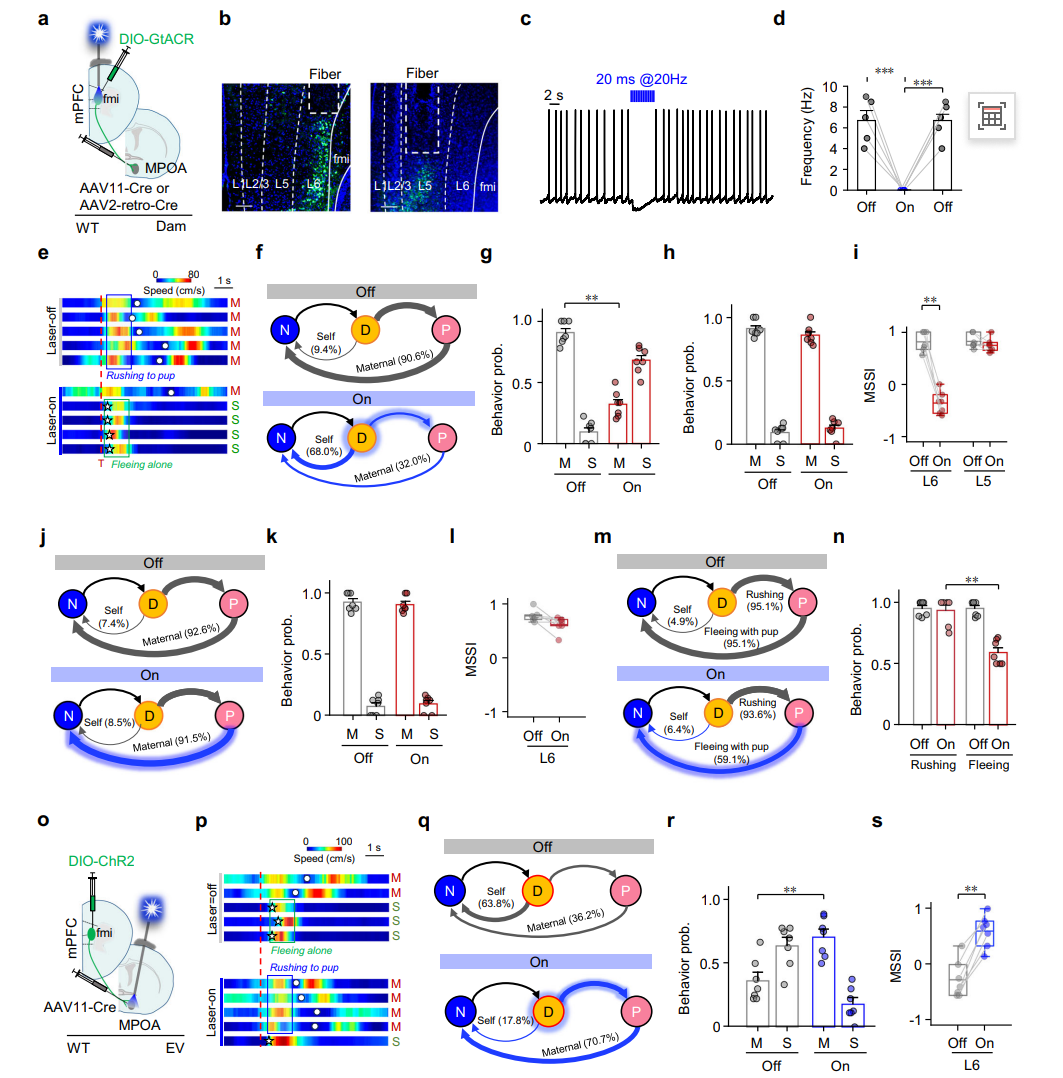
图7 投射到MPOA的mPFC L6神经元调节母体的行为选择
mPFC投射至MPOA的L6 D1神经元活性随母性经验增强并调控防御行为
通过多阶段纵向钙成像与环路示踪实验,系统揭示了mPFC投射至MPOA的L6神经元在母性经验积累过程中的动态变化及其功能特性。
已知多巴胺(DA)通路影响动机行为及母鼠对后代的反应,为探究投射至MPOA的mPFC L6神经元是否受DA调控,研究向Drd1-Cre::Ai14小鼠MPOA注射逆行示踪剂CTB-488(图8a),发现投射至MPOA的mPFC L6神经元约90%与D1受体共标(图8b-d),L5中这类共标神经元极少(图8c),且多数表达D1的神经元也会投射至MPOA(图8d)。综上,介导母性防御决策的mPFC神经元可能主要是D1神经元,建立了DA通路与母性防御行为的关联。
研究结果显示(图8f-g),同一批小鼠从无经验处女阶段到有经验处女阶段再到母鼠阶段,其母性防御选择指数随经验积累逐步升高;钙成像数据显示(图8h-m),这些L6神经元中"趋近型"细胞的比例和活性在母鼠阶段显著增强,且这种增强是状态依赖而非年龄依赖(图8n-q)。这些结果共同表明,mPFC→MPOA通路中L6 D1神经元的活性增强与母性经验的积累密切相关,其状态依赖性激活是驱动母性防御行为成熟的关键神经可塑性机制。
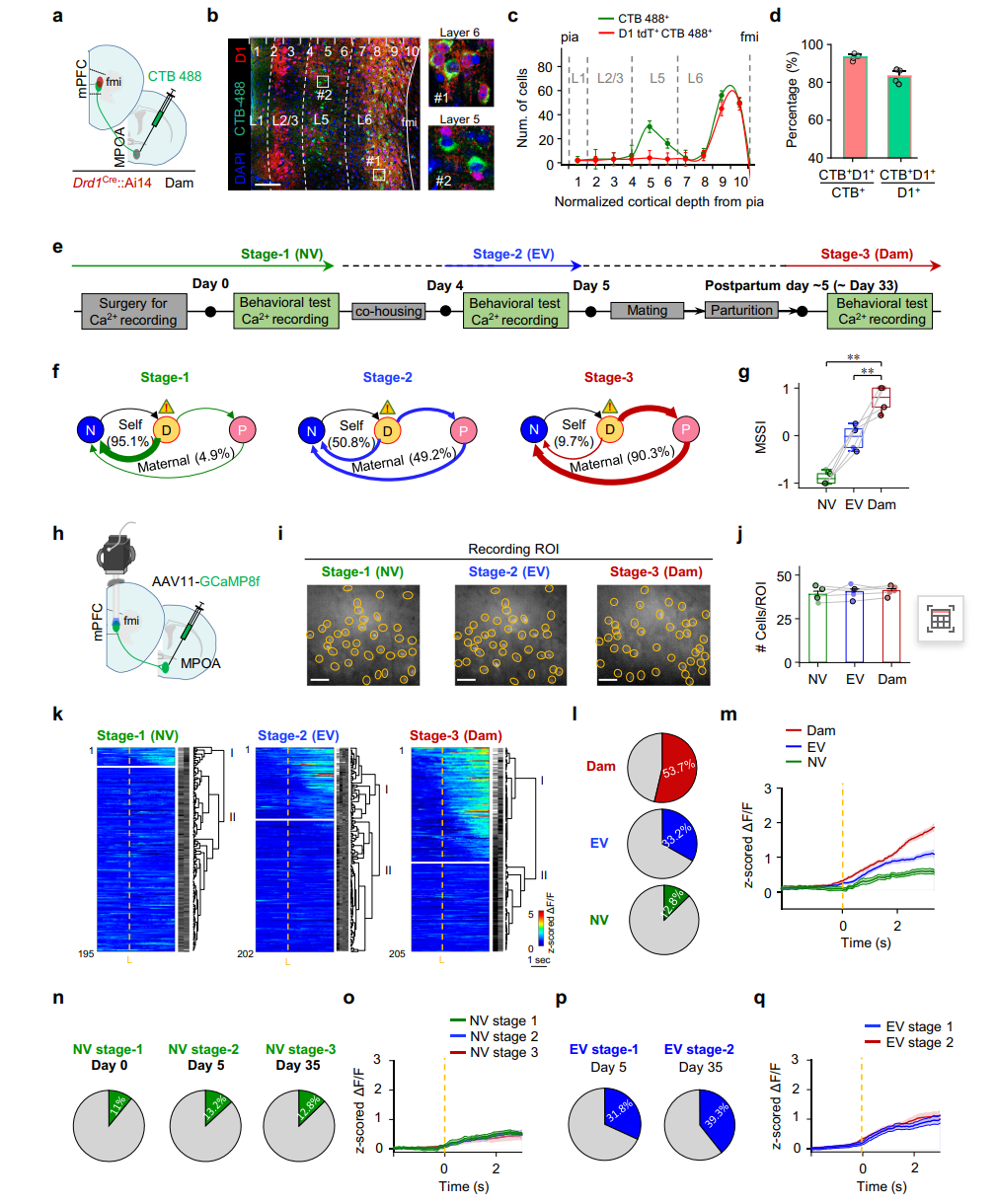
图8投射至MPOA的mPFC L6 D1神经元母体状态依赖性激活
MPOA投射的mPFC L6 D1神经元调控基础母性动机并增强威胁下的防御行为
为阐明mPFC→MPOA通路是否在非威胁情境中同样调控母性行为,文章在母鼠和EV小鼠中分别对投射至MPOA的L6神经元进行抑制性和兴奋性操控。在无威胁的常规幼崽取回测试中,当动物越过行为场中线时给予光刺激(图9a-f),结果显示:抑制母鼠该通路可降低其幼崽取回倾向(图9a-c),而激活经验雌鼠该通路则能提升其取回概率(图9d-f),表明该投射对母性行为具有普遍的动机增强作用,且不依赖于威胁信号的存在。
进一步通过在D1-Cre小鼠MPOA区域注射AAV11-DIO-GCaMP8s,研究者特异性记录了投射至该区的D1神经元在PRUT测试中的活性动态(图9g)。在母鼠中,约48.9%的D1神经元表现为“趋近相关”细胞,13.0%为“取回相关”细胞(图9h)。趋近相关细胞不仅在威胁条件下于幼崽接近阶段活性显著上升(图9i左),在无威胁的正常取回过程中同样出现活动增强(图9i右),其群体平均钙信号在两种情境下均呈现上升趋势(图9j)。进一步分析显示,威胁刺激可显著增强该细胞群在趋近阶段的活动斜率(图9k),说明危险信号能进一步放大该通路中D1神经元的动员程度,从而特异性地强化母性防御动机。
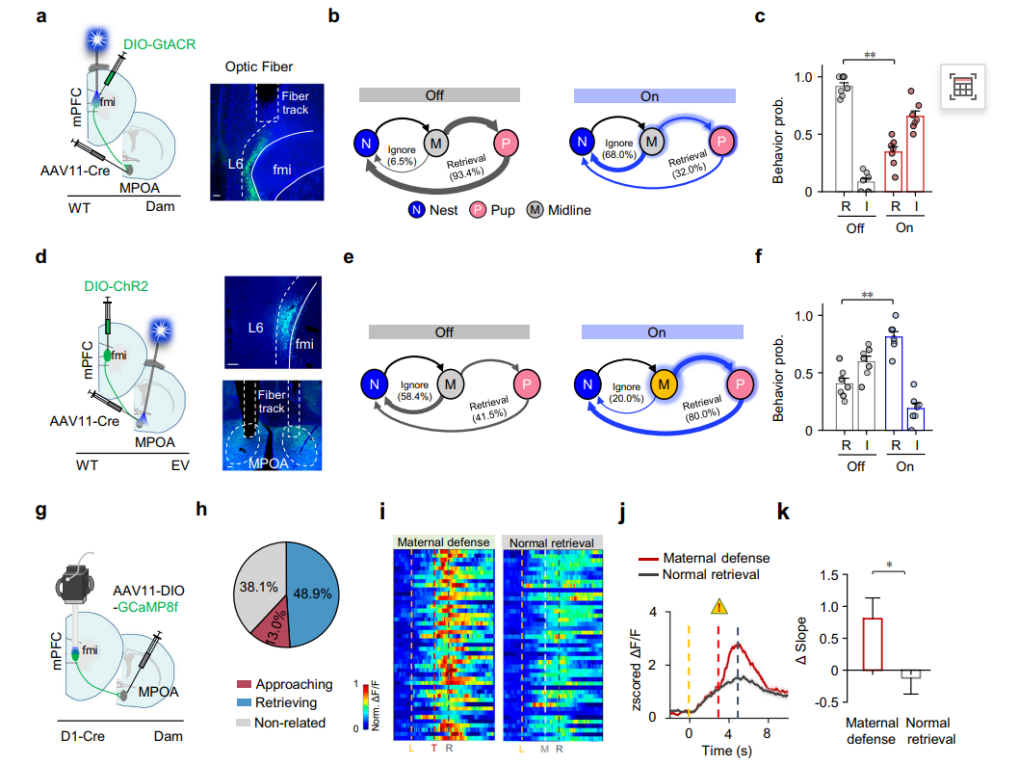
图9 投射至MPOA的mPFC L6神经元在母性抚育行为中的功能作用和威胁相关激活
总 结
本研究揭示了小鼠母性防御行为的核心神经机制:内侧前额叶皮层第6层表达D1受体的神经元,通过向内侧视前区的特异性投射,构成危险情境下“母性优先于自保”决策的关键通路。该通路活性随母性经验增强,既能普遍促进母性照料动机,又在威胁信号调控下特异性驱动防御行为,阐明了从自我保存到后代保护的行为转换的神经基础。
实验延伸与应用展示:
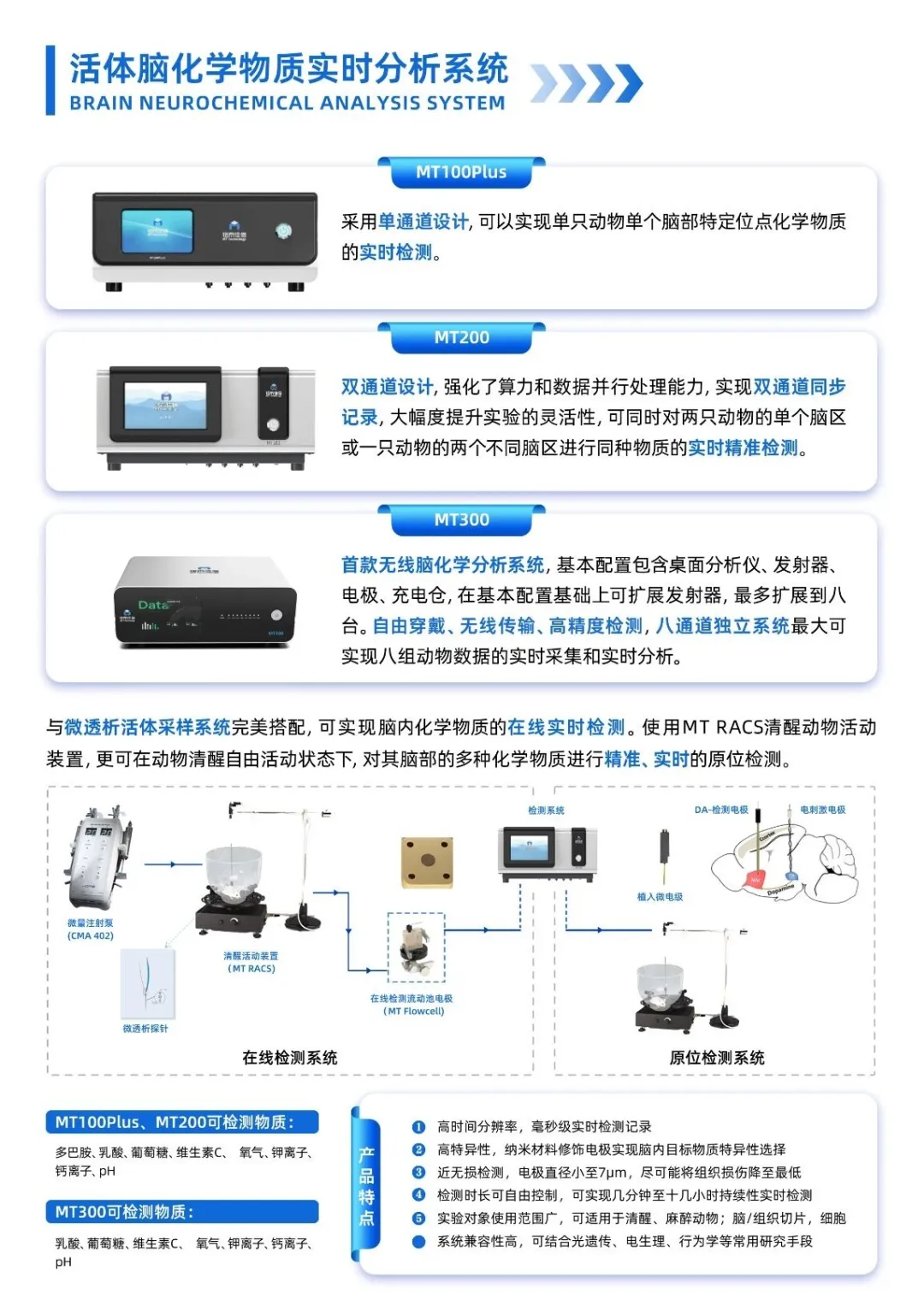
本研究揭示了“D1多巴胺受体神经元调控母性防御决策”的关键环路机制,为进一步探究行为背后的神经化学动力学提供了明确的研究方向。基于上述发现,利用北京铭泰佳信自主研发的活体脑内化学物质实时分析系统,能够在清醒自由活动的动物中连续实时捕捉多巴胺等物质的动态变化,可开展以下验证与延伸实验,旨在为该神经环路机制提供直接的在体、实时化学动力学证据:
核心延伸实验设计:
在自由活动的母鼠执行“威胁下幼崽救援”行为范式时,于其内侧前额叶皮层(mPFC)植入多巴胺特异性微电极,实现毫秒级实时监测该脑区多巴胺浓度的动态变化。通过将神经化学信号与动物的行为决策(冲向幼崽或独自逃跑)进行精准时序对齐,可直观验证:
1、在威胁出现的关键决策时刻,mPFC是否出现特异性多巴胺释放;
2、该多巴胺信号在经验母鼠、有经验处女鼠与无经验处女鼠之间的表达差异;
3、多巴胺释放的动力学特征(如幅度、上升时间、持续时间)能否预测个体的行为选择。
本系统在本研究中的价值体现:
该实验能够实现在自由活动动物体内,对特定神经调质在行为过程中的变化进行实时、长时程监测,从而:
1、机制验证与完善:为原文中“D1受体”的关键作用提供其上游配体——多巴胺释放的直接证据,完整揭示“多巴胺释放→D1受体激活→神经元集群兴奋→行为输出”的因果链条。
2、多模态数据整合:将神经化学信号与神经元钙活动记录及高精度行为分析进行跨层次关联,实现从分子、细胞到环路与行为的系统性机制解析。
3、状态依赖性追踪:长期监测同一动物从处女状态到母性状态转变过程中,脑内化学环境的动态演变,为“母性经验如何重塑大脑功能”提供化学动力学层面的直接证据。
展示的系统核心能力:
通过本延伸实验,可清晰展示活体脑化学物质实时分析系统在自由活动动物中,对特定神经化学物质实现:
1、高时空分辨率监测:稳定捕捉与短暂行为事件(如决策瞬间)相关的快速化学波动;
2、长时程稳定记录:支持跨天数、跨行为状态的连续化学信号追踪;
3、多行为范式兼容:适用于包括威胁决策、社会交互、学习记忆等多种复杂行为模型。
该工具为解析复杂行为背后的化学编码机制提供了可靠、灵敏的研究平台,有望推动神经环路与行为调控研究进入“化学实时解析”的新阶段。
原文链接:10.1038/s41467-025-6306